
Secciones
Servicios
Destacamos

REDACCIÓN
Jueves, 4 de noviembre 2021, 18:05
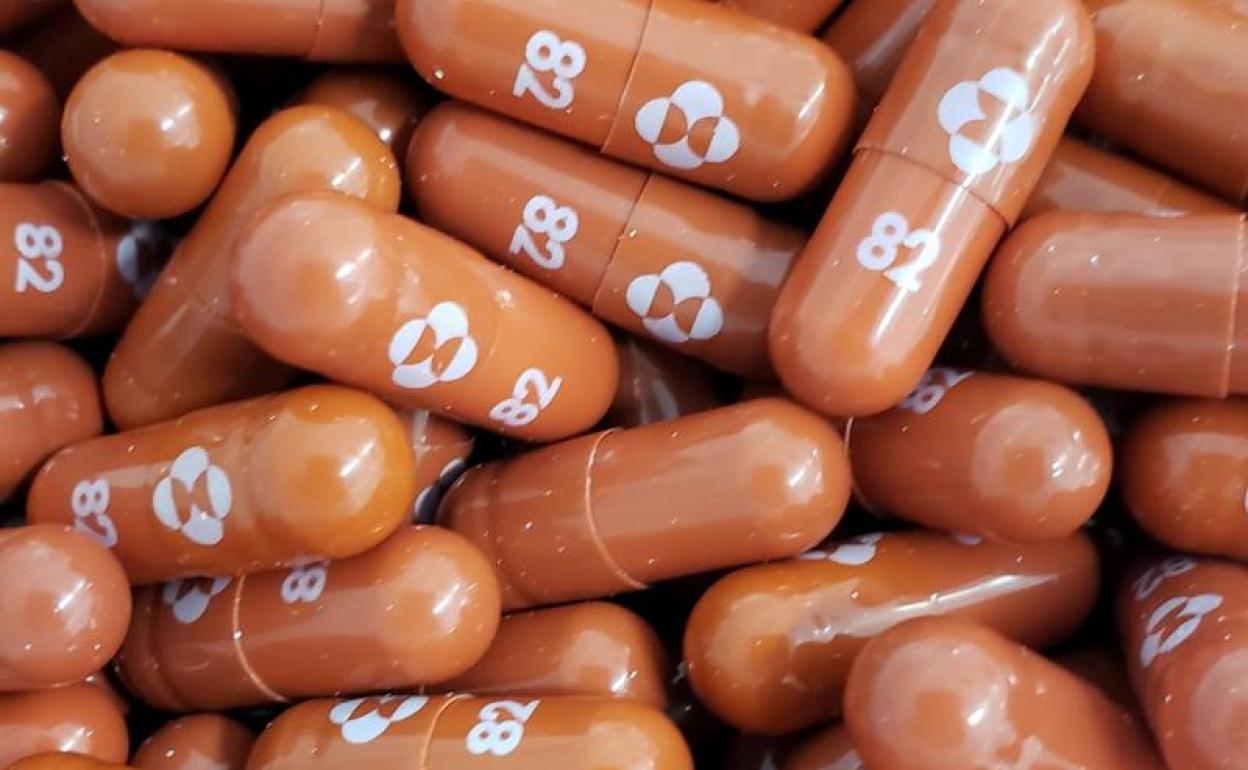
El molnupiravir se ha convertido en la primera pastilla contra el covid-19 aprobada por la EMA, que ha avalado el uso de emergencia de este antiviral del laboratorio Merck Sharp & Dohme Corp., (MSD). La decisión del CHMP (comité de medicamentos humanos) de la EMA (Agencia Europea del Medicamento) se basa en los resultados preliminares de los estudios clínicos y de laboratorio (datos no clínicos). Estos estudios sugieren que el medicamento puede reducir la capacidad del SARS CoV 2 (el virus que causa COVID-19) para multiplicarse en el cuerpo, evitando así la hospitalización o la muerte en pacientes con COVID-19.
La aprobación de estas pastillas, que brindan una esperanza considerable para descongestionar los servicios hospitalarios durante el invierno, se da en el mismo momento en que la Unión Europea las evalúa frente a una ola masiva de contagios.
Noticia Relacionada
Comercializado con el nombre de Lagevrio, molnupiravir fue primero autorizado por la Agencia de medicamentos del Reino Unido, MHRA, para su uso en personas con covid leve a moderado y que tienen al menos un factor de riesgo de desarrollar una enfermedad grave (obesidad, más de 60 años, diabetes, enfermedades cardíacas).
Los antivirales como el molnupiravir actúan disminuyendo la capacidad de un virus para replicarse, lo cual frena la enfermedad.
Su aplicación puede ser doble: por un lado, para que las personas ya infectadas no padezcan síntomas graves, y también para que no desarrollen la enfermedad quienes han estado en contacto cercano.
En todo caso, los expertos han advertido que este tratamiento no es una solución milagrosa y que si bien complementa las vacunas, no las reemplaza.
Merck ya comenzó la producción a gran escala de molnupiravir y tiene previsto fabricar las dosis necesarias para 10 millones de tratamientos antes de fin de año. Además, el grupo ya llegó a acuerdos con algunos gobiernos, entre ellos Estados Unidos (1,7 millones de tratamientos) y Francia (50.000 dosis).
Su precio es elevado, el pedido realizado por Estados Unidos asciende a 700 dólares por dosis.
Merck también está realizando un ensayo clínico por aparte para un segundo uso del tratamiento, como medida preventiva para que las personas que han estado en contacto cercano con el virus, no lo desarrollen.
La biotecnológica Atea Pharmaceuticals y el laboratorio Roche evalúan la eficacia de un tratamiento comparable. Por último, Pfizer está desarrollando un medicamento que combina dos moléculas, incluido el ritonavir.
El molnupiravir (MK-4482 / EIDD-2801) es una forma experimental administrada por vía oral de un potente análogo de ribonucleósido que inhibe la replicación del SARS-CoV-2, el agente causante del COVID-19. Se ha demostrado que molnupiravir es activo en varios modelos preclínicos de SARS-CoV-2, incluso para la profilaxis, el tratamiento y la prevención de la transmisión. Además, los datos preclínicos y clínicos han demostrado que molnupiravir es activo contra las variantes más comunes del SARS-CoV-2.
El molnupiravir se inventó en Drug Innovations at Emory (DRIVE), LLC, una empresa de biotecnología sin fines de lucro propiedad en su totalidad de Emory University, y está siendo desarrollado por Merck & Co., Inc. en colaboración con Ridgeback Biotherapeutics. Ridgeback recibió un pago por adelantado de Merck y también es elegible para recibir pagos contingentes dependiendo del logro de ciertos hitos de aprobación regulatorios y de desarrollo. Cualquier beneficio de la colaboración se dividirá entre los socios por igual. Desde que obtuvo la licencia de Ridgeback, todos los fondos utilizados para el desarrollo de molnupiravir han sido proporcionados por Merck y Wayne y Wendy Holman de Ridgeback.
Molnupiravir también se está evaluando para la profilaxis posterior a la exposición en MOVe-AHEAD, un estudio de fase 3 global, multicéntrico, aleatorizado, doble ciego y controlado con placebo, que evalúa la eficacia y seguridad de molnupiravir para prevenir la propagación de COVID-19 dentro de los hogares.
Publicidad
Publicidad
Te puede interesar
Publicidad
Publicidad
Esta funcionalidad es exclusiva para suscriptores.
Reporta un error en esta noticia
Comentar es una ventaja exclusiva para suscriptores
¿Ya eres suscriptor?
Inicia sesiónNecesitas ser suscriptor para poder votar.