
Secciones
Servicios
Destacamos

a.p.
Sábado, 18 de febrero 2023, 00:45
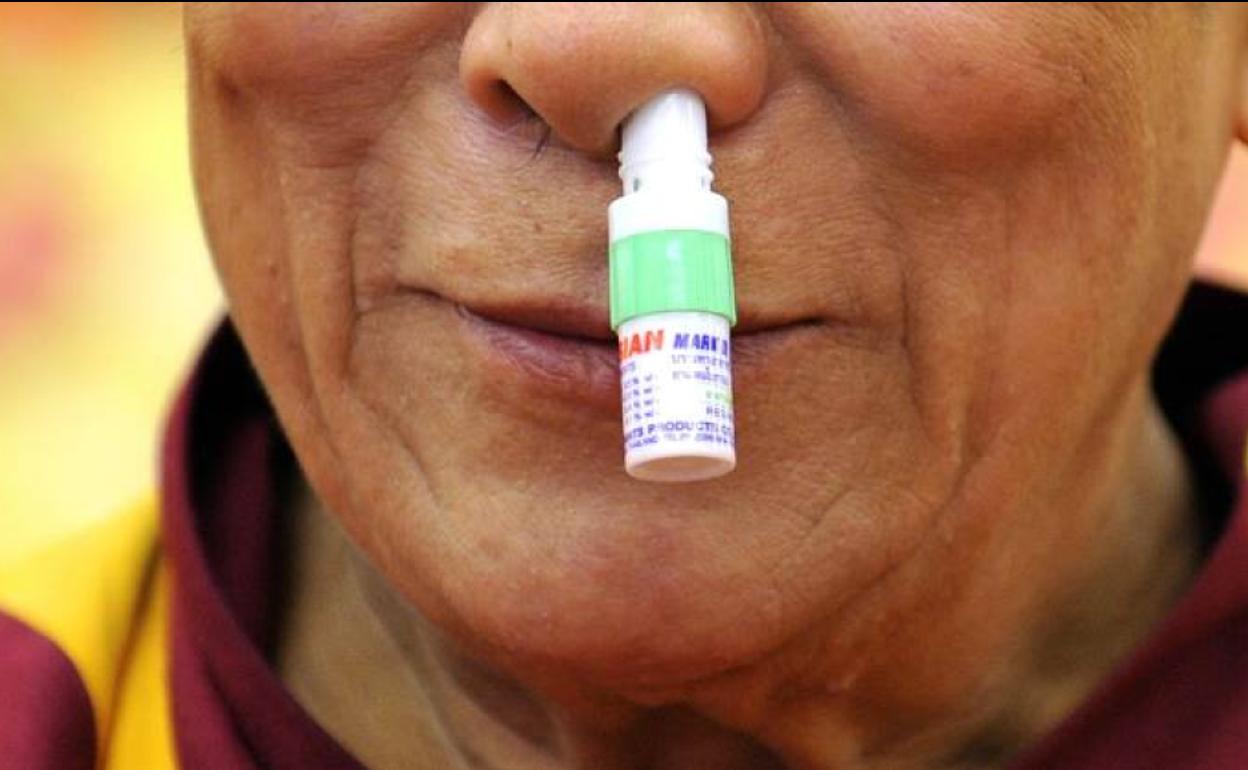
Desde que comenzó la pandemia la venta de los espráis nasales se ha incrementado de manera exponencial. Muchas personas utilizan este producto para descongestionar sus conductos nasales y respirar mejor. Es por ello que la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha notificado, principalmente, a los fabricantes y organismos acerca de que algunos de estos productos no contaban con los datos clínicos necesarios para demostrar su eficacia frente al virus SARS-CoV-2.
En la notificación se recuerdan los aspectos regulatorios esenciales que deben cumplir los espráis nasales con indicaciones viricidas o microbiocidas antes de su puesta en el mercado como productos sanitarios. A continuación, alguno de los puntos más importantes que han de tener en cuenta también los consumidores:
El fabricante es responsable en todo momento de que el producto esté cualificado y calificado a su legislación aplicable, teniendo en cuenta su finalidad prevista y su mecanismo de acción. De esta manera, se considerarán productos sanitarios los que ejerzan su acción principal por un medio principalmente mecánico o físico, aunque puedan contener un medicamento con una acción accesoria a la principal. En el caso de los espráis nasales, requieren siempre la intervención de un organismo notificado en el procedimiento de evaluación de su conformidad.
Antes de comercializar un espráy nasal en el mercado como producto sanitario, el fabricante debe especificar y justificar el nivel de evidencia clínica necesario para demostrar la conformidad del producto, con los requisitos generales de seguridad y funcionamiento aprobados en el Parlamento Europeo. Algunos de ellos son:
- Los datos clínicos que muestran las reivindicaciones del producto deben aparecer en la documentación técnica. También debe mostrar su funcionamiento y seguridad.
- Las consideraciones relativas a la equivalencia entre productos deben basarse en una justificación científica adecuada teniendo en cuenta sus características técnicas, biológicas y clínicas.
- Los organismos notificados deben verificar que el producto cuente con información clínica suficiente y apropiada, que demuestre la acción reivindicada por el fabricante del producto antes de emitir un certificado de marcado CE.
En la información del etiquetado del producto se debe mostrar su finalidad prevista y las reivindicaciones sobre su funcionamiento deben ser acordes con el beneficio probado del producto. En este caso, no se debe indicar una acción contra COVID-19 si el espray no ha sido probado específicamente en el virus SARS-CoV-2.
Publicidad
Publicidad
Te puede interesar
Publicidad
Publicidad
Esta funcionalidad es exclusiva para suscriptores.
Reporta un error en esta noticia
Comentar es una ventaja exclusiva para suscriptores
¿Ya eres suscriptor?
Inicia sesiónNecesitas ser suscriptor para poder votar.